2023年5月6日/医麦客新闻 eMedClub News/–近日,西比曼生物科技宣布与强生旗下杨森(Janssen)公司达成一项全球独家合作,以开发、制造和商业化用于治疗B细胞恶性肿瘤的下一代新型CAR-T细胞治疗产品C-CAR039(靶向CD19/CD20)和C-CAR066(靶向CD20)。
根据协议条款,杨森将获得C-CAR039和C-CAR066两款CAR-T细胞治疗产品在中国以外地区独家开发权,以及在中国地区开发的优先选择权。西比曼生物科技将获得2.45亿美元的首付款。在实现某些预定的临床开发、监管申报、商业化和销售里程碑后,西比曼生物科技还将获得多笔里程碑付款。商业化后,西比曼生物科技还将从杨森的净销售额中获得销售分成。
这是杨森继2017年与传奇生物达成BCMA CAR-T产品合作后,再度出手引进中国biotech研发的CAR-T细胞产品;同时,本次合作也是自纳斯达克回调以来,中国细胞治疗领域排名前3的巨额交易。
这不禁引人遐想:西比曼或将成为全球的下一个“传奇”,甚至超越“传奇”。
持续创新,缔造Best In Class eMedClub
西比曼生物作为国内老牌的细胞疗法企业,力争在血液瘤和实体瘤细胞治疗领域打造Best-in-Class产品。在细胞免疫疗法版块,其CAR-T平台建立在经过充分研究的慢病毒载体和第二代CAR设计之上,虽然这是目前大多数临床试验和研究都使用的设计,但西比曼在此基础上依然不断革新着潜在的治疗效果。
在2021年ASCO年会上,西比曼公布了CD19/CD20双靶点 CAR-T(C-CAR039)用于治疗R/R B-cell NHL的最新临床数据:在34例可评估的患者中,客观缓解率(ORR)达到92.6%,完全缓解率(CR)达到85.2%,无疑是潜在的同类最优产品。这款产品采用4-1BB作为共刺激域,搭载其自主研发且受专利保护的、经优化的双特异性抗原结合结构域,可同时作用于CD19和CD20双靶点,已被证明可以在体内和体外有效清除CD19/CD20单阳性或双阳性肿瘤细胞。目前,C-CAR039正在美国进行一项治疗R/R DLBCL患者的Ib期研究,暂未观察到≥3级的细胞因子释放综合征(CRS)和免疫效应细胞相关神经毒性综合征(ICANS)。
据悉,C-CAR039的GMP生产是在无血清且完全封闭的半自动系统中进行的,进一步保障了其终产品的安全性,并且,其制备周期中位数在6-7天左右,vein-to-vein的中位时间在19-20天左右,可大大缩短患者的等待时间,提高可及性。
正是基于其优异的早期临床表现以及未来潜在的商业化能力,CAR039已被FDA授予快速通道资格和再生医学先进疗法资格,用于治疗复发/难治性弥漫性大B细胞淋巴瘤(R/R DLBCL),同时还获得了FDA的孤儿药资格认定,用于治疗滤泡性淋巴瘤(FL),这两大疾病都是NHL领域最常见的适应症。
C-CAR066则是一款以CD20抗原为靶点的新型第二代CAR-T,已获得FDA的新药临床批准,预计将于2023年下半年开始在R/R DLBCL患者中进行Ib期研究。其临床前研究表明,与传统的CD20 CAR-T(Leu16 scFV)和CD19 CAR-T(FMC63 scFV)相比,改进后的C-CAR066的抗肿瘤活性更强。根据2021年在ASCO年会上公布的数据显示,该药对于接受CD19 CAR-T治疗失败后的R/R B-cell NHL患者具有良好的安全性和有效性。在中位随访4.2个月(1.2~11.7个月)时,最佳总缓解率达100%,其中完全缓解(CR)率为70.0%(7/10)。
从以上数据可以看出,针对NHL这一大适应症,虽然此前已有诺华的Kymriah、Gilead/Kite的Yescarta以及国内复星凯特和药明巨诺的两款CD19 CAR-T产品相继上市,但强生依然愿意花重金从西比曼引入这两款临床早期的CAR-T产品,无疑是看中了其“同类最优”的潜力,未来必定可以在全球市场占有重要的一席之地。
回想2017年,强生与传奇生物以3.5亿美元首付款达成合作,彼时全球的CAR-T治疗赛道仅两款产品获批上市,且均为CD19靶向,可以说这一合作是从0到1的选择。而今时今日,市场上已有多款同类产品上市,强生此时再入局,有种势在“杀出重围”的自信,那这必将是一个更加传奇的故事。
因此,此次强生引进西比曼的两款CAR-T产品不仅意味着强生试图凭借这两款产品在拥挤的DLBCL赛道实现后来者居上的野心。同时,于西比曼而言,与强生这一深度合作也是其打造全球生物医药生态体系的重要一环,这也展示出公司的长远发展潜力。
另外值得一提的是,西比曼另一款BCMA CAR-T产品C-CAR088在R/R MM患者中ORR也高达96.4%,这些数据支撑可能为血液瘤患者带来一种更佳的治疗选择;而在实体瘤方面,其第二代自体GPC3 CAR-T细胞产品C-CAR031已在肝细胞癌中初步显示了不俗疗效,在安全性和疗效方面具有突出优势。
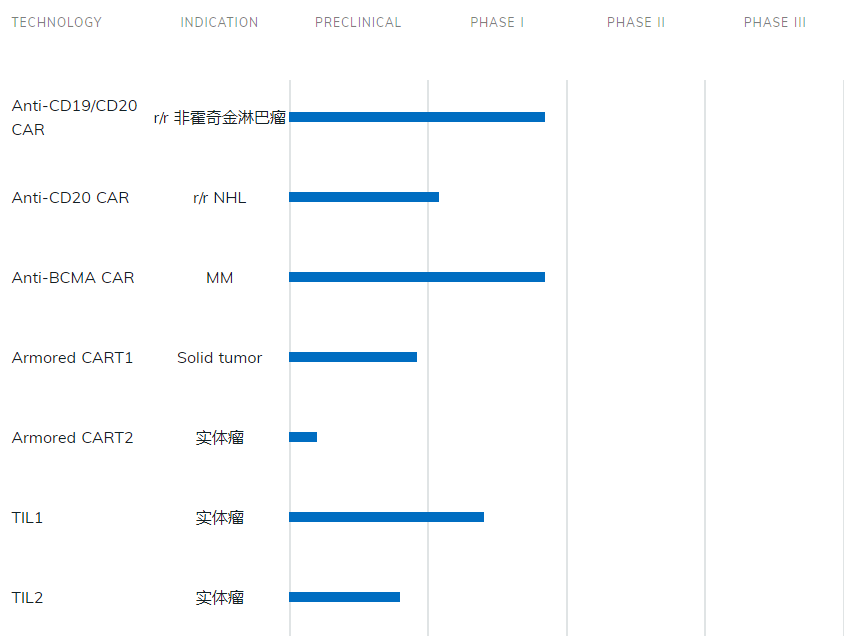
▲ 肿瘤免疫研发管线(图源:西比曼官网)
C-CAR031的产品原型由AstraZeneca(阿斯利康)设计,包括经过安全性优化的抗原识别scFv(单链可变区)以及基于AstraZeneca全球创新细胞治疗发现平台开发的装甲型负显性TGF-βII型受体。在今年的AACR大会上,西比曼公布了C-CAR031的首次人体(FIH)I期临床试验数据。
结果显示,C-CAR031在具有良好的安全性、耐受性的同时展现出积极的临床抗肿瘤疗效:根据RECIST v1.1和mRECIST标准,在6例晚期肝细胞癌的探索剂量组(DL2剂量组)中3例受试者达到了确认的部分缓解(PR)、2例受试者达到了疾病稳定;到数据截止日,所有部分缓解(PR)的受试者仍然保持持续缓解。C-CAR031显示出强大的细胞药物(代谢)动力学特征,在末次随访中,所有患者的血液中都能持续检测到CAR-T细胞。暂未观察到剂量限制毒性(DLT)或神经毒性(ICANS)。
因为优秀,备受青睐 eMedClub
然而,与强生的合作并不是西比曼首次受到MNC机构青睐,凭借其优异的产品管线和细胞治疗产品开发能力,早前就曾与诺华达成合作、获得阿斯利康的投资,成为国内首家同时获得两大跨国制药巨头认可的细胞疗法公司,这也在一定程度上说明中国的细胞疗法研发企业正在逐步走向全球,其创新能力正在赶超国际水平。
➤ 2018年9月,诺华制药与西比曼生物基于前者的CAR-T药物Kymriah在中国的生产签订合作,西比曼生物生物负责制造工艺,诺华负责中国的分销、监管和商业化方面的工作。西比曼以每股27.43美元的价格向诺华公司出售约9%的股权,获得4000万美元的股权收购款。诺华则可在全球范围内获得部分西比曼CAR-T相关技术的免版税知识产权。
➤ 2021年9月,西比曼生物宣布完成了1.2亿美元的A轮融资,由阿斯利康中金医疗产业基金、红杉资本、云锋基金共同领投,新加坡政府投资公司(GIC)、泰福资本等老股东跟投。本轮融资将主要用于推进CD19/CD20双靶点CAR-T疗法C-CAR039未来在中国和美国的临床研究,以及加速BCMA CAR-T疗法C-CAR088针对MM的临床开展。与此同时,作为下一步的战略重点,该公司也将全力推动下一代针对实体瘤的细胞疗法(armored CAR-T 和TIL)、干细胞外泌体疗法等多条管线的开发,以及加速已进入3期临床的AlloJoin异体脂肪间充质干细胞治疗膝骨关节炎的临床及商业化进程。
结语 eMedClub
CAR-T作为创新疗法的代表,目前已有8款产品获批上市。而目前国内外开发的CAR-T产品中,已然出现CD19与BCMA靶点扎堆现象,同质化竞争日趋严重。然而正如一位业内人士所言,有时候,内卷未必是坏事,更高水平的创新也会由此产生。
西比曼生物正是通过这样的高价值创新“打破内卷”,其不断展现出的创新能力正在受到跨国药企越来越多的认可,这也大大为其未来的发展稳固了基础。去年,强生从传奇生物引进的针对多发性骨髓瘤的BCMA CAR-T疗法Carvykti获得美国FDA批准,成为中国首个成功“出海”的CAR-T疗法,并凭借出色的疗效,市场表现极佳,在2023年第一季度带来了7200万美元的销售额。未来,西比曼凭借其CAR-T产品以创新的技术、独特的靶点设计以及优异的安全性和疗效或能缔造下一个“传奇”。